Hcl'de hidrojen bağı bulunur mu?
Hidroklorik asit (HCl), hidrojen ve klor elementlerinden oluşan bir asittir. Bu makalede, HCl'deki hidrojen bağlarının varlığı ve sulu çözeltideki etkileri incelenmektedir. Hidrojen bağları, HCl'nin fiziksel ve kimyasal özelliklerini şekillendiren önemli etkileşimlerdir.
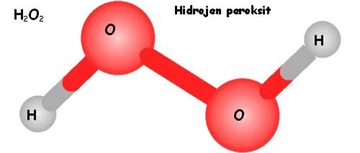
Hidroklorik asit (HCl), kimyasal formülü HCl olan ve genellikle sulu çözeltisi olarak bulunan bir asittir. Bu asidin temel bileşenleri hidrojen (H) ve klor (Cl) elementleridir. HCl'nin kimyasal yapısı ve özellikleri, özellikle hidrojen bağlarının varlığı açısından önem taşımaktadır. Bu makalede, HCl'de hidrojen bağı bulunup bulunmadığı incelenecektir. Hidrojen Bağı Nedir?Hidrojen bağı, genellikle bir hidrojen atomu ile daha elektronegatif bir atom arasında oluşan zayıf bir etkileşimdir. Bu etkileşim, hidrojen atomunun, başka bir atomun (genellikle oksijen, azot veya flor) elektronlarına çekilmesiyle meydana gelir. Hidrojen bağları, moleküller arası etkileşimlerde önemli bir rol oynar ve birçok biyolojik ve kimyasal süreçte kritik öneme sahiptir. Hidrojen Bağlarının HCl'deki Varlığı Hidroklorik asitte, hidrojen atomu klor atomuna bağlıdır ve bu bağ, bir kovalent bağdır. Ancak, HCl molekülleri arasında hidrojen bağlarının oluşup oluşmadığı sorusu, HCl'nin fiziksel durumuna ve ortam koşullarına bağlıdır. HCl, sulu çözelti halinde bulunduğunda, HCl molekülleri su molekülleri ile etkileşime girebilir.
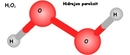
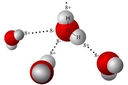
Sulu Çözelti ve İyonik Yapı Hidroklorik asidin sulu çözeltisi, HCl'nin tamamen iyonlaşması sonucu oluşan H+(hidrojen iyonu) ve Cl-(klorür iyonu) ile karakterizedir. Bu durumda, H+iyonu su molekülleri ile etkileşime girdiğinde, hidrojen bağları oluşturabilir.
Sonuç Hidroklorik asitte doğrudan hidrojen bağı bulunmamakla birlikte, sulu çözelti içerisinde H+iyonları ile su molekülleri arasında hidrojen bağları oluşabilir. Bu etkileşim, HCl'nin kimyasal özelliklerini ve biyolojik sistemlerdeki rolünü anlamak açısından önemlidir. Sonuç olarak, HCl'nin hidrojen bağı oluşturma kapasitesi, onun fiziksel ve kimyasal davranışlarını şekillendiren temel unsurlardan biridir. Ekstra Bilgiler Hidroklorik asit, sindirim sisteminde önemli bir rol oynamaktadır. Mide asidinin ana bileşeni olarak, besinlerin sindirilmesinde ve patojenlerin öldürülmesinde etkili bir madde olarak görev yapar. Ayrıca, laboratuvarlarda ve endüstriyel süreçlerde yaygın olarak kullanılmaktadır. HCl'nin özellikleri ve etkileşimleri, kimya ve biyoloji alanında derinlemesine incelenmeye değer bir konudur. |









.webp)






Hidroklorik asidin sulu çözeltisinde hidrojen bağlarının varlığını merak ettiğimde, HCl'nin fiziksel durumunun ve ortam koşullarının etkisini anladım. HCl molekülleri su ile etkileşime girdiğinde gerçekten de hidrojen bağları oluşabiliyor mu? Bu etkileşim, asidin çözünürlüğünü ve özelliklerini nasıl etkiliyor? Özellikle, H+ iyonlarının su molekülleriyle etkileşimi sonucunda ortaya çıkan bu bağların rolü nedir? Bu konuda daha fazla bilgi edinmek, HCl'nin kimyasal davranışlarını anlamama yardımcı olabilir mi?
Hidrojen Bağları ve HCl
Salık, hidroklorik asidin sulu çözeltisinde hidrojen bağlarının varlığı oldukça ilginç bir konudur. HCl, su molekülleri ile etkileşime girdiğinde, hidrojen iyonları (H+) ve klorür iyonları (Cl-) oluşur. Su, polar bir molekül olduğundan, H+ iyonları su molekülleri ile güçlü hidrojen bağları oluşturabilir. Bu bağlar, H+ iyonlarının su ortamında stabil kalmasını sağlar ve çözeltinin özelliklerini etkiler.
Asidin Çözünürlüğü ve Özellikleri
HCl'nin su içindeki çözünürlüğü, bu hidrojen bağlarının varlığı sayesinde artar. Su molekülleri, H+ iyonlarını çevreleyerek onları stabilize eder ve böylece asidin çözünmesi kolaylaşır. Bu durum, asidin güçlü bir asit olmasının nedenlerinden biridir; çünkü H+ iyonları, su ortamında serbestçe hareket edebilir ve asidik özellikler gösterir.
H+ İyonlarının Rolü
H+ iyonlarının su molekülleriyle etkileşimi, asidik özelliklerin belirleyici bir faktörüdür. Bu etkileşim, pH seviyesinin düşmesine neden olarak çözeltiyi asidik hale getirir. H+ iyonları, su ile olan etkileşimleri sayesinde hidrojen bağları oluşturarak, çözeltideki reaktifliği artırır. Bu durum, HCl’nin kimyasal davranışlarını anlamanıza yardımcı olabilir; çünkü asidin güçlü karakteri, H+ iyonlarının su ile oluşturduğu bu dinamik etkileşimlerden kaynaklanır.
Sonuç olarak, hidrojen bağları, HCl'nin sulu çözeltisindeki davranışını ve özelliklerini etkileyen önemli bir faktördür. Bu konuda daha fazla bilgi edinmek, asidin kimyasal özelliklerini ve davranışlarını anlamanızı derinleştirebilir.