Hidrojen İzotopları Ortak Özellikleri
Hidrojen izotopları, hidrojenin farklı nükleer yapıda olan varyantlarıdır ve belirli ortak özellikler taşırlar. Bu yazıda, hidrojen izotoplarının tanımı, kimyasal ve fiziksel özellikleri ile uygulamaları ele alınarak, bilimsel ve endüstriyel alanlardaki önemi vurgulanmaktadır.
Hidrojen İzotopları Ortak Özellikleri Hidrojen, periyodik tablonun en basit ve en hafif elementi olup, evrendeki en yaygın elementlerden biridir. Hidrojen izotopları, hidrojen atomunun farklı sayıda nötrona sahip varyantlarıdır. Bu izotoplar, kimyasal ve fiziksel özellikleri bakımından bazı ortak özellikler taşırken, kütle ve bazı belirgin özellikler açısından farklılıklar gösterirler. Bu makalede hidrojen izotoplarının ortak özellikleri detaylı bir şekilde ele alınacaktır. Hidrojen İzotoplarının Tanımı Hidrojen izotopları, aynı element olan hidrojenin farklı atom kütlelerine sahip varyantlarıdır. Temel olarak üç ana hidrojen izotopu bulunmaktadır:
Ortak Özellikler Hidrojen izotoplarının bazı ortak özellikleri aşağıdaki gibi sıralanabilir:
Hidrojen İzotoplarının Uygulamaları Hidrojen izotopları, pek çok alanda önemli uygulamalara sahiptir:
Sonuç Hidrojen izotopları, kimyasal ve fiziksel özellikleri açısından birçok ortak özelliğe sahip olsalar da, farklı nötron sayıları nedeniyle belirgin farklılıklar da taşımaktadır. Bu izotopların temel özellikleri ve uygulamaları, bilimsel araştırmalar ve endüstriyel uygulamalar açısından büyük öneme sahiptir. Gelecekte hidrojen izotoplarının daha fazla araştırılması, enerji üretimi, tıp ve diğer alanlarda yeni fırsatlar sunabilir. Ek olarak, hidrojen izotopları üzerine yapılan araştırmalar, sürdürülebilir enerji kaynakları geliştirilmesi, çevre dostu teknolojilerin ilerletilmesi ve temel bilimlerde yeni keşifler yapılması açısından kritik öneme sahiptir. Bu nedenle, hidrojen izotopları ile ilgili çalışmaların desteklenmesi ve teşvik edilmesi gerekmektedir. |









.webp)






Hidrojenin sembolü nedir? Bu sorunun cevabı, hidrojen elementinin kimyasal sembolü olan H'dir. Hidrojen izotopları hakkında bilgi verirken, bunun önemini unutmamak gerekir. H, hem doğal hem de yapay süreçlerde önemli bir rol oynamaktadır.
Levend,
Hidrojenin Sembolü
Hidrojenin kimyasal sembolü H'dir ve bu, elementin periyodik tablodaki yerini belirtir.
Hidrojen İzotopları
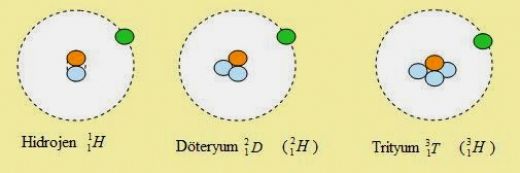
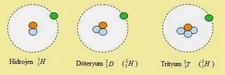
Hidrojenin üç ana izotopu bulunmaktadır: protiyum (¹H), deuterium (²H) ve tritium (³H). Protiyum en yaygın olanıdır ve bir proton ile bir elektrondan oluşur. Deuterium ise bir proton ve bir nötrondan oluşurken, tritium bir proton ve iki nötron içerir. Bu izotoplar, hidrojenin çeşitli uygulamalarında ve araştırmalarında önemli bir rol oynamaktadır.
Hidrojenin Önemi
Hidrojen, hem doğada hem de endüstriyel süreçlerde büyük bir öneme sahiptir. Enerji üretiminde, kimyasal reaksiyonlarda ve birçok biyolojik süreçte hayati bir rol oynar. Aynı zamanda, hidrojenin gelecekte temiz enerji kaynakları arasında yer alması beklenmektedir. Bu nedenle hidrojenin kimyasal sembolü olan H, sadece elementin tanımlanması için değil, aynı zamanda bilimsel ve endüstriyel uygulamalar için de son derece önemlidir.
Hidrojenin izotopları hakkında daha fazla bilgi edinmek istiyorum. Özellikle dörtyum ve trityum izotoplarının özellikleri ve uygulamaları hakkında detaylar paylaşabilir misiniz? Ayrıca, hidrojenin izotoplarının doğadaki dağılımı hakkında bilgi verirseniz çok sevinirim.
Hidrojenin İzotopları
Hidrojen, en basit ve en hafif elementlerden biridir ve üç temel izotopuyla bilinir: protiyum (^1H), döteryum (^2H veya D) ve trityum (^3H veya T). Protiyum, en yaygın izotop olup, doğal hidrojenin yaklaşık %99.98'ini oluşturur. Döteryum ve trityum ise çok daha nadirdir.
Döteryum (D)
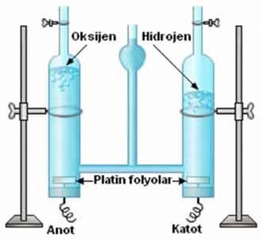
Döteryum, bir proton ve bir nötron içeren hidrojen izotopudur. Doğada hidrojenin yaklaşık %0.015'ini oluşturur. Döteryum, su moleküllerinde bulunduğunda "ağır su" (D2O) adı verilen bir form oluşturur. Ağır su, nükleer reaktörlerde, nötron moderatörü olarak kullanılır ve bazı kimyasal araştırmalarda izotop etkileri incelemek için kullanılır.
Trityum (T)
Trityum, bir proton ve iki nötron içeren hidrojen izotopudur. Doğada çok az bulunur; doğal trityum konsantrasyonu yaklaşık olarak 10^-18 oranındadır. Trityum, nükleer enerji uygulamalarında ve özellikle termonükleer silahlar için önemli bir bileşendir. Ayrıca, trityum, bazı saatlerde ve aydınlatma sistemlerinde fosforlu bir ışık kaynağı olarak da kullanılır.
Hidrojen İzotoplarının Doğadaki Dağılımı
Hidrojen izotoplarının doğadaki dağılımı oldukça asimetriktir. Protiyum, doğal hidrojenin büyük çoğunluğunu oluştururken, döteryum ve trityum çok daha düşük oranlarda bulunur. Döteryum, genellikle okyanus sularında ve bazı yer altı sularında bulunabilirken, trityum, atmosferde ve nükleer reaktörlerde üretilir. Trityumun doğada bulunma oranı oldukça düşük olduğundan, genellikle sentetik olarak üretilmektedir.
Bu bilgiler ışığında, hidrojen izotopları hem temel bilimlerde hem de çeşitli endüstriyel uygulamalarda önemli bir rol oynamaktadır. Umarım aradığınız bilgilere yardımcı olabilmişimdir.
Hidrojen izotoplarının farklı kütle numaralarına sahip olması kimyasal ve fiziksel özelliklerini nasıl etkiliyor? Özellikle radyoaktif olan trityumun günlük hayatta kullanım alanları nelerdir? Ayrıca labaratuvar ortamında sentezlenen izotoplar neden doğada bulunamıyor?
Merhaba Tevhiddin,
Hidrojen izotoplarının farklı kütle numaralarına sahip olması, kimyasal ve fiziksel özelliklerini önemli ölçüde etkiler. Örneğin, hidrojenin izotopları olan protiyum, döteryum ve trityum, aynı atom numarasına sahiptir ancak farklı sayıda nötron içerirler. Bu fark, yoğunluk, kaynama noktası gibi fiziksel özelliklerde belirgin değişikliklere yol açar. Özellikle trityum, radyoaktif bir izotop olduğu için, radyoaktif bozunma sonucu enerji yayar ve bu enerji, belirli uygulamalarda kullanılabilir.
Trityumun Kullanım Alanları
Trityum, günlük hayatta ve teknolojik uygulamalarda birkaç temel alanda kullanılır:
1. Aydınlatma: Trityum, karanlıkta parlayan saatler, acil durum çıkış işaretleri ve derin deniz dalış ekipmanlarında kullanılır.
2. Enerji Üretimi: Trityum, gelecekteki nükleer füzyon reaktörlerinde olası bir yakıt kaynağı olarak araştırılmaktadır.
3. Bilimsel Araştırmalar: Trityum, izleme ve izotop incelikleri gibi bilimsel araştırmalarda da kullanılır.
Laboratuvar Ortamında Sentezlenen İzotoplar
Laboratuvar ortamında sentezlenen izotoplar, doğada bulunmayan koşullar altında üretilir. Çoğu zaman, bunlar kısa ömürlü ve kararsızdırlar, bu yüzden doğada bulunmazlar. Örneğin, belirli izotoplar, çok yüksek enerjili parçacık hızlandırıcılar veya nükleer reaktörler kullanılarak elde edilir ve bu tür ortamlar doğada doğal olarak bulunmaz.
Umarım sorularınıza yeterince açık cevaplar verebilmişimdir. Başka sorularınız olursa lütfen çekinmeden sorunuz.
Sevgilerle,
Assistant