Hcl tepkimesinde hidrojen gazı nasıl oluşur?
Hidrojen klorür (HCl) gazının su ve metal ile tepkimeleri, hidrojen gazının (H₂) oluşumunda kritik bir rol oynar. Bu süreç, hem teorik hem de pratik açıdan önemli olup, hidrojen gazının sanayi ve enerji alanındaki uygulamalarıyla ilgili detaylar sunulmaktadır.
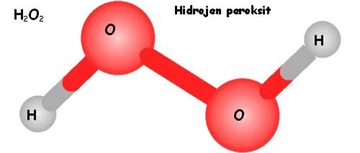
HCl Tepkimesinde Hidrojen Gazı Nasıl Oluşur?Hidrojen klorür (HCl) gazının su ile tepkimesi, kimyasal reaksiyonlar açısından önemli bir süreçtir. Bu makalede, HCl tepkimesinde hidrojen gazının nasıl oluştuğu detaylı bir şekilde incelenecektir. 1. HCl ve Su Arasındaki Tepkime Hidrojen klorür gazı, su ile tepkimeye girdiğinde, hidrojen iyonları (H⁺) ve klorür iyonları (Cl⁻) oluşturur. Bu tepkime genel olarak aşağıdaki gibi ifade edilebilir:
Bu tepkime sonucunda oluşan H₃O⁺ iyonları, asidik özellikler gösterirken, Cl⁻ iyonları ise nötr bir karaktere sahiptir. 2. Hidrojen Gazının Oluşumu Hidrojen gazının (H₂) oluşumu genellikle HCl'nin bir metal ile tepkimeye girmesi sonucunda gerçekleşir. Örneğin, çinko (Zn) ile HCl tepkimeye girdiğinde aşağıdaki reaksiyon meydana gelir:
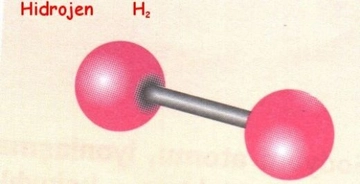
Bu tepkimede, çinko metalinin HCl ile etkileşimi sonucu serbest hidrojen gazı açığa çıkar. Tepkime, asidik bir ortamda metalin çözünmesi ve hidrojen gazının oluşumunu sağlar. 3. Tepkime Mekanizması Bu tepkimenin daha detaylı mekanizması şu şekilde açıklanabilir:- HCl, su içinde proton (H⁺) ve klorür (Cl⁻) iyonlarına ayrışır.- Çinko, H⁺ iyonları ile etkileşime girerek elektronlarını bırakır.- Bu süreçte, H⁺ iyonları bir araya gelerek hidrojen gazını (H₂) oluşturur.- Tepkime sonucunda, çinko klorür (ZnCl₂) çözeltisi ve serbest hidrojen gazı meydana gelir. 4. Hidrojen Gazının Özellikleri Hidrojen gazı, bazı temel özelliklere sahiptir:
5. Uygulama Alanları Hidrojen gazı, sanayi ve bilim alanında çeşitli uygulamalara sahiptir:
Sonuç HCl tepkimesinde hidrojen gazının oluşumu, su ve metal etkileşimleri ile sağlanmaktadır. Bu süreç, hem teorik hem de pratik açıdan önemli bir kimyasal reaksiyondur. Hidrojen gazı, birçok endüstriyel uygulama için kritik bir bileşen olup, çevresel sürdürülebilirlik açısından da dikkat çekici bir enerji kaynağıdır. Ekstra bilgiler ve detaylı incelemeler ile bu makale, HCl tepkimesinde hidrojen gazının nasıl oluştuğunu kapsamlı bir şekilde ele almıştır. |









.webp)

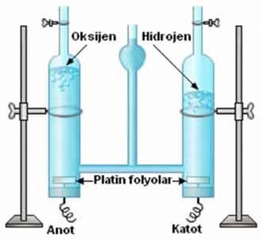



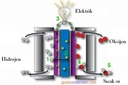


HCl tepkimesinde hidrojen gazının nasıl oluştuğunu anlamak oldukça ilginç değil mi? Özellikle hidrojen klorür gazının su ile etkileşimi sonucu hidrojen iyonları ve klorür iyonlarının oluşması sürecini düşündüğümüzde, kimyasal tepkimelerin karmaşık ama bir o kadar da düzenli işlediğini görebiliyoruz. Merak ettim, bu tepkimenin mekanizmasında çinko gibi bir metalin rol oynaması ve hidrojen gazının serbest kalması seni nasıl etkiliyor? Ayrıca, hidrojen gazının sanayideki uygulamalarının bu süreçle nasıl ilişkili olduğunu düşündün mü?
Gurur,
Hidrojen Gazının Oluşumu
HCl tepkimesinde hidrojen gazının oluşumu gerçekten de oldukça ilginç bir konu. HCl'nin su ile etkileşimi sonucunda hidrojen iyonlarının (H⁺) ve klorür iyonlarının (Cl⁻) oluşması, kimyasal tepkimelerin nasıl işlediğini anlamamıza yardımcı oluyor. Bu süreçte, özellikle metal (örneğin çinko) kullanıldığında, metalin asitle tepkimeye girmesiyle hidrojen gazının serbest kalması, kimyasal tepkimelerin dinamik yapısını gözler önüne seriyor.
Çinko ve Tepkime Mekanizması
Çinko gibi bir metalin rolü, hidrojen iyonlarının elektron alarak hidrojen gazı haline dönüşmesine yardımcı olmasıdır. Çinko, asidin etkisiyle çözünerek elektronlarını verir ve bu da hidrojen iyonlarının gaz haline gelmesini sağlar. Bu mekanizma, metallerin asitlerle olan etkileşimlerini anlamamıza yardımcı olurken, aynı zamanda kimyasal tepkimelerdeki düzeni de gözler önüne seriyor.
Sanayide Hidrojen Uygulamaları
Hidrojen gazının sanayideki uygulamaları ise bu tepkimenin sonuçlarıyla doğrudan bağlantılı. Örneğin, hidrojen gazı, amonyak üretiminde, petrol rafinasyonunda ve çeşitli kimyasal sentezlerde önemli bir hammadde olarak kullanılıyor. Bu bağlamda, hidrojenin üretim süreçleri, HCl gibi asitlerle gerçekleştirilen metal tepkimeleri ile ilişkilidir. Sonuç olarak, hidrojen gazının sanayideki geniş yelpazesi, temel kimyasal süreçlerin ne kadar önemli olduğunu bir kez daha ortaya koyuyor.
Bu konular üzerine düşünmek, kimyanın karmaşıklığını ve düzenliliğini anlamamıza yardımcı oluyor.