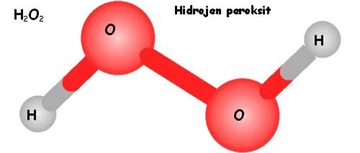
Hidrojenin sahip olduğu elektron sayısı nedir?
Hidrojen, periyodik tablodaki en basit ve en hafif elementtir. Bir proton ve bir elektrondan oluşarak, kimyasal özelliklerini belirleyen önemli bir yapıya sahiptir. Hidrojenin tek elektronu, reaktivitesini artırarak çeşitli bileşiklerin oluşumuna katkıda bulunur.
Hidrojenin Sahip Olduğu Elektron Sayısı Nedir?Hidrojen, periyodik tabloda en basit ve en hafif element olarak yer almaktadır. Kimyasal sembolü "H" olan hidrojenin atom yapısı ve özellikleri, bilimsel araştırmaların ve kimya derslerinin temel konularından birini oluşturur. Bu makalede hidrojenin sahip olduğu elektron sayısı, atom yapısı ve bu sayının kimyasal özellikler üzerindeki etkileri detaylı bir şekilde ele alınacaktır. Hidrojen Atomunun Yapısı Hidrojen atomu, sadece bir proton ve bir elektrondan oluşur. Bu durum, hidrojenin en basit atom yapısına sahip olmasına neden olur. Atom yapısı, temel olarak proton, nötron ve elektronlardan oluşur, ancak hidrojenin atom çekirdeğinde yalnızca bir proton bulunmaktadır. Bu nedenle hidrojen, nötr bir atom olarak kabul edildiğinde yalnızca bir elektrona sahiptir.
Hidrojenin Elektron Sayısının Önemi Hidrojenin sahip olduğu elektron sayısı, onun kimyasal davranışlarını belirleyen en önemli faktörlerden biridir. Elektronlar, atomların kimyasal bağlar kurma yeteneklerini etkiler. Hidrojenin tek bir elektrona sahip olması, onu reaktif hale getirir ve diğer elementlerle kolayca etkileşime girmesini sağlar.
Hidrojenin Elektron Konfigürasyonu Hidrojenin elektron konfigürasyonu, onun kimyasal özellikleri ve davranışları hakkında önemli bilgiler sunar. Elektron konfigürasyonu, bir atomun elektronlarının enerji seviyelerine dağılımını ifade eder. Hidrojen atomu için bu konfigürasyon 1s¹ şeklinde ifade edilir. Bu, hidrojenin birinci enerji seviyesinde tek bir elektrona sahip olduğu anlamına gelir.
Sonuç Sonuç olarak, hidrojen atomu bir proton ve bir elektrondan oluşmakta olup, bu nedenle elektron sayısı 1'dir. Bu basit yapısı, hidrojenin kimyasal özelliklerini ve reaktivitesini büyük ölçüde etkiler. Hidrojen, birçok kimyasal bileşiğin temel bileşeni olarak önemli bir rol oynamaktadır ve modern bilimin birçok alanında araştırmaların merkezinde yer almaktadır. Ekstra Bilgiler Hidrojen, evrende en bol bulunan elementtir ve yıldızların enerji üretiminde önemli bir rol oynar. Aynı zamanda hidrojenin enerji taşıyıcı olarak kullanımı, yenilenebilir enerji kaynakları ve hidrojen yakıt hücreleri gibi teknolojilerde de önemli bir yer tutmaktadır. |









.webp)

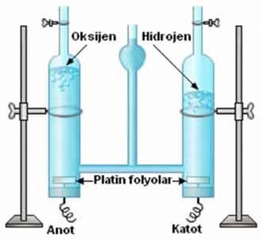





Hidrojenin sahip olduğu elektron sayısı ile ilgili olarak, yalnızca bir elektrona sahip olmasının kimyasal özelliklerini nasıl etkilediğini düşündünüz mü? Bu durumun hidrojenin reaktifliğini artırdığı ve farklı bileşikler oluşturmasına olanak tanıdığı gerçekten ilginç değil mi? Ayrıca, hidrojenin elektron konfigürasyonunun bu denklemleri nasıl etkilediği hakkında daha fazla bilgi edinmek ister misiniz?
Merafi,
Hidrojenin Elektron Sayısı ve Kimyasal Özellikleri
Hidrojenin yalnızca bir elektrona sahip olması, onun kimyasal özelliklerini oldukça etkiler. Bu durum, hidrojenin reaktifliğini artıran ve farklı bileşikler oluşturmasını kolaylaştıran bir etken olarak öne çıkar. Tek bir elektron, hidrojenin dış enerji seviyesini tamamlamak için kolayca diğer atomlarla etkileşime girmesine olanak tanır. Bu da hidrojenin, özellikle ametallerle kolayca bileşikler oluşturmasını sağlar.
Reaktiflik ve Bileşik Oluşumu
Hidrojen, diğer elementlerle oluşturduğu bağlar sayesinde çok çeşitli bileşikler meydana getirir. Örneğin, oksijenle birleştiğinde suyu, karbonla birleştiğinde ise organik bileşikleri oluşturur. Bu nedenle hidrojen, kimyasal reaksiyonlarda önemli bir rol oynar ve birçok farklı bileşiğin temel yapı taşıdır.
Elektron Konfigürasyonu ve Denklemler
Hidrojenin elektron konfigürasyonu basit bir yapıdadır (1s¹). Bu durum, onun kimyasal denklemlerde nasıl davrandığını anlamamıza yardımcı olur. Elektronların düzenlenişi, bağ yapma yeteneğini ve dolayısıyla reaktifliğini belirler. Hidrojen, daha stabil bir yapı elde etmek için elektron kazanabilir veya kaybedebilir; bu da onun çeşitli kimyasal reaksiyonlarda yer almasını sağlar.
Sonuç olarak, hidrojenin tek elektronlu yapısı, onun kimyasal reaktivitesini ve çeşitliliğini artıran önemli bir özelliktir. Bu konuda daha fazla bilgi edinmek istersen, her zaman yardımcı olmaktan mutluluk duyarım.