Hidrojen ve döteryum farklı allotroplar mı?
Hidrojen ve döteryum, kimyasal ve fiziksel özellikleri bakımından benzerlikler gösterse de, izotopik farklılıkları nedeniyle birbirlerinden ayrılırlar. Bu makalede, her iki elementin özellikleri, uygulama alanları ve allotropik durumları detaylı bir şekilde ele alınacaktır.
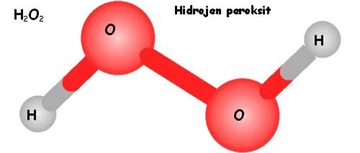
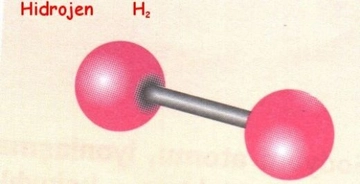
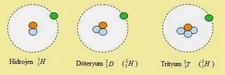
Hidrojen ve Döteryum: Farklı Allotroplar mı?Hidrojen, periyodik tablonun en hafif ve en basit elementidir. Kimyasal formülü H olan bu element, evrende en çok bulunan elementlerden biridir. Döteryum ise hidrojenin izotopu olup, kimyasal formülü D veya ^2H olarak gösterilir. Bu makalede, hidrojen ve döteryum arasındaki farklar, allotropik durumları ve fiziksel ve kimyasal özellikleri incelenecektir. Hidrojenin Temel Özellikleri Hidrojen, 1 proton ve 1 elektrondan oluşur. Sıvı hale geçmesi için -253°C'ye kadar soğutulması gerekir. Hidrojen, renksiz, kokusuz ve tatsız bir gazdır. Normal koşullarda iki atomlu moleküller (H2) halinde bulunur. Döteryumun Temel Özellikleri Döteryum, 1 proton, 1 nötron ve 1 elektrondan oluşur. Bu ekstra nötron, döteryumun hidrojenin bir izotopu olmasına yol açar. Döteryum da sıvı hale geçmesi için benzer bir soğumaya ihtiyaç duyar, ancak döteryumun sıvı hali, hidrojenin sıvı haline göre daha yüksek bir kaynama noktasına sahiptir (yaklaşık -249°C). Döteryum, genellikle D2 veya ^2H2 molekülleri halinde bulunur. Allotropik Kavramı Allotrop, bir elementin farklı fiziksel formlarını tanımlar. Örneğin, karbonun allotropları arasında grafit ve elmas bulunur. Ancak hidrojen ve döteryum, izotopik farklılıkları nedeniyle farklı allotrop olarak kabul edilmezler. Allotrop terimi genellikle aynı elementin atomik veya moleküler yapısındaki farklılıklara atıfta bulunur. Hidrojen ve Döteryum Arasındaki Farklar Hidrojen ve döteryum arasındaki temel farklılıklar şu şekildedir:
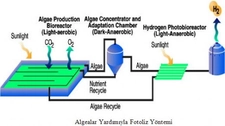
Uygulama Alanları Hidrojen ve döteryum, çeşitli sanayi ve bilimsel uygulamalarda kullanılır.
Sonuç Sonuç olarak, hidrojen ve döteryum, kimyasal özellikleri ve uygulamaları bakımından birbirine benzerlik gösterse de, fiziksel ve izotopik farklılıklar nedeniyle farklı elementler olarak kabul edilirler. Ancak, her ikisi de farklı allotropik formlar olarak değerlendirilmez; çünkü allotrop kavramı, aynı elementin farklı fiziksel şekilleri için geçerlidir. Bu nedenle, hidrojen ve döteryum, birbirinin izotoplarıdır ve farklı allotroplar olarak sınıflandırılamazlar. |









.webp)

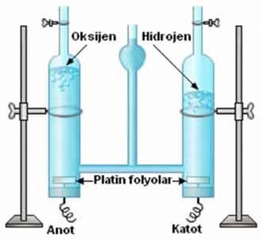



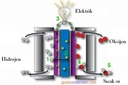


Hidrojen ve dötaryum arasındaki benzerlikler ve farklar hakkında düşündüğümde, bu iki elementin birbirine ne kadar yakın olmasına rağmen, neden farklı izotoplar olarak sınıflandırıldıklarını merak ediyorum. Özellikle dötaryumun ekstra nötronu sayesinde fiziksel özelliklerinin değişmesi, kimyasal tepkimelerdeki farklılıkları nasıl etkiliyor? Ayrıca, dötaryumun nükleer füzyon araştırmalarındaki rolü gerçekten çok ilginç; bu konuda daha fazla bilgi sahibi olmak isterdim. Sizce hidrojen ve dötaryumun uygulama alanları arasında gelecekte hangi gelişmeler olabilir?
Sayın Müştehir,
Hidrojen ve Dötaryumun Benzerlikleri: Hidrojen ve dötaryum, her ikisi de aynı element olan hidrojenin izotoplarıdır. Bu nedenle, her ikisi de kimyasal özellikler bakımından oldukça benzerlik gösterirler. Her ikisi de aynı sayıda protona sahiptir (bir proton) ve bu sayede benzer kimyasal reaksiyonlara girerler.
Farklılıklar ve Fiziksel Özellikler: Dötaryum, hidrojenin bir izotopu olarak, bir ekstra nötrona sahiptir ve bu, onun atom kütlesini artırır. Bu ekstra nötron, dötaryumun fiziksel özelliklerinde değişikliklere yol açar; örneğin, kaynama ve erime noktaları hidrojeninkinden daha yüksektir. Bu tür fiziksel farklılıklar, kimyasal tepkimelerde de ufak farklılıklara neden olabilir. Örneğin, dötaryumun daha ağır olması, bazı reaksiyonların hızını etkileyebilir; bu da "izotop etkisi" olarak bilinir.
Dötaryumun Nükleer Füzyon Araştırmalarındaki Rolü: Dötaryum, nükleer füzyon araştırmalarında önemli bir yere sahiptir. Çünkü dötaryum ve trityumun birleşimi, büyük miktarda enerji açığa çıkarır. Bu nedenle, gelecekte temiz enerji kaynakları arayışında dötaryumun kullanımı büyük bir potansiyele sahiptir. Dötaryum, nükleer reaktörlerde ve füzyon deneylerinde kullanılarak, daha verimli enerji üretimi sağlama amacı taşır.
Gelecekteki Gelişmeler: Hidrojen ve dötaryumun uygulama alanları arasında gelecekte özellikle enerji üretimi ve depolama teknolojileri üzerinde önemli gelişmeler olabilir. Dötaryumun kullanımı ile nükleer enerji üretiminde daha temiz ve sürdürülebilir yöntemler geliştirilebilir. Ayrıca, hidrojen yakıt hücreleri ve diğer enerji sistemlerinin verimliliği artırılabilir. İleri teknoloji ile dötaryumun daha verimli kullanımı, enerji krizinin çözümünde önemli bir adım olabilir.
Saygılarımla,