Hidrojen klorürün lewis yapısı nasıldır?
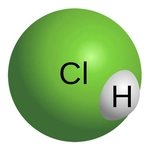
Hidrojen klorür (HCl) molekülünün Lewis yapısını incelemek, atomlar arası bağların ve elektron dağılımının anlaşılmasına yardımcı olur. Bu yapı, hidrojen ve klor elementlerinin elektron dizilimlerini göz önünde bulundurarak, molekülün kimyasal özelliklerini ve davranışlarını anlamada kritik bir rol oynar.
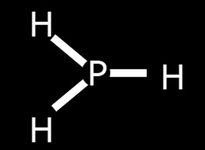
Hidrojen Klorürün Lewis Yapısı Hidrojen klorür (HCl), hidrojen ve klor elementlerinden oluşan basit bir kimyasal bileşiktir. Bu bileşiğin Lewis yapısının anlaşılması, molekül içindeki atomlar arasındaki bağların ve elektron dağılımının kavranması açısından büyük önem taşımaktadır. Lewis yapısı, bir moleküldeki atomların bağlanma durumunu ve valans elektronlarının dağılımını gösteren bir modeldir. Hidrojen ve Klor Elementlerinin Elektron Dizilimi Hidrojen (H) ve klor (Cl) elementlerinin elektron dizilimleri, Lewis yapısının oluşturulmasında temel bir rol oynamaktadır.
Lewis Yapısının Oluşturulması Hidrojen klorürün Lewis yapısını oluşturmak için aşağıdaki adımlar izlenir:
Lewis Şeması ve Bağ Yapısı Hidrojen klorürün Lewis şeması şu şekildedir: H: 1 elektronCl: : : : : : (7 elektron) Bu gösterimde, H atomu Cl atomuna bir elektron bağışlar ve böylece HCl molekülü oluşur. Klor atomu, H atomuyla oluşan bağın yanı sıra kendi valans elektronları ile 3 çift (6 elektron) daha bulundurarak toplamda 8 elektronla oktet kuralını sağlamış olur. Hidrojen Klorürün Özellikleri Hidrojen klorür, kimyasal özellikleri açısından oldukça önemli bir bileşiktir. Aşağıda bazı temel özellikleri listelenmiştir:
Sonuç Hidrojen klorürün Lewis yapısı, molekül içindeki atomların bağlanma düzenini ve elektron dağılımını anlamak için önemli bir araçtır. Bu yapının analizi, kimyasal bağların ve moleküler yapıların incelenmesinde temel bir rol oynamaktadır. Hidrojen klorür, özellikleri ve kullanımları ile kimya alanında önemli bir bileşiktir. |









.webp)