Hidrojen Klorür (HCl) Molekülünün Yapısal Özellikleri
Hidrojen klorür (HCl), bir hidrojen atomu ile bir klor atomunun kovalent bağ ile bağlanması sonucu oluşan diatomik (iki atomlu) bir moleküldür. Molekülün yapısı ve özellikleri şu şekildedir:
1. Atomların Bağlanması ve Molekül Geometrisi
- HCl molekülü, hidrojen (H) ve klor (Cl) atomlarının tek bir kovalent bağ ile bağlanmasıyla oluşur.
- Molekül doğrusal (lineer) bir geometriye sahiptir, çünkü sadece iki atom bulunur ve aralarındaki bağ açısı 180 derecedir.
- Klor atomu, hidrojen atomundan daha elektronegatif olduğu için bağ kutupludur. Bu nedenle HCl polar bir moleküldür.
2. Bağ Uzunluğu ve Enerjisi
- Hidrojen ve klor atomları arasındaki bağ uzunluğu yaklaşık 127,4 pikometre (pm) veya 1,274 Ångström'dür.
- Bağ enerjisi ise yaklaşık 431 kJ/mol'dür, bu da bağın oldukça güçlü olduğunu gösterir.
3. Elektron Dağılımı ve Kutupluluk
- Kovalent bağ, hidrojen ve klor atomları arasında bir çift elektronun paylaşılmasıyla oluşur.
- Klorun elektronegatifliği (3,16) hidrojeninkinden (2,20) daha yüksek olduğu için, bağ elektronları klor atomuna doğru çekilir. Bu durum, klor atomunda kısmi negatif (δ-), hidrojen atomunda ise kısmi pozitif (δ+) yük oluşmasına neden olur.
- Sonuçta HCl, net bir dipol momente sahip polar bir moleküldür.
4. Fiziksel ve Kimyasal Özellikler
- HCl, oda sıcaklığında renksiz, keskin kokulu bir gazdır.
- Su ile temas ettiğinde hidroklorik asit çözeltisini oluşturur ve bu çözelti güçlü bir asittir.
- Molekül ağırlığı 36,46 g/mol'dür ve sudaki çözünürlüğü oldukça yüksektir.
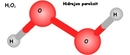
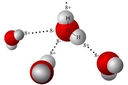
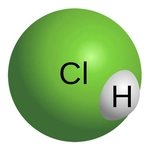
5. Molekül Modeli Gösterimi
- Çubuk-top modelinde, H ve Cl atomları bir çubukla (bağ) birleştirilmiş küreler olarak temsil edilir.
- Uzay dolgu modelinde, atomların van der Waals yarıçaplarına göre boyutlandırılmış küreler kullanılır; klor atomu hidrojen atomundan daha büyük gösterilir.
- Lewis yapısında ise H: Cl veya H–Cl şeklinde gösterilir, paylaşılan elektron çifti bir çizgi ile ifade edilir.
HCl molekülü, basit yapısına rağmen kimyasal reaksiyonlarda önemli bir role sahiptir ve endüstride yaygın olarak kullanılan hidroklorik asidin temel bileşenidir. |









.webp)