Hidrojen klorür modeli nedir ve nasıl çalışır?
Hidrojen klorür, hidrojen ve klor elementlerinin birleşiminden oluşan önemli bir kimyasal bileşiktir. Hem fiziksel hem de kimyasal özellikleriyle dikkat çeker ve endüstriyel süreçlerde yaygın bir şekilde kullanılır. Asidik özellikleri sayesinde birçok kimyasal reaksiyonda rol oynar.
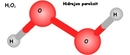
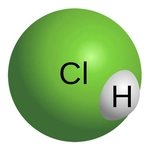
Hidrojen Klorür Modeli Nedir?Hidrojen klorür (HCl), hidrojen ve klor elementlerinin birleşiminden oluşan bir kimyasal bileşiktir. Sıvı halinde renksiz, keskin kokulu bir gazdır ve suda çözünerek hidroklorik asidi oluşturur. Hidrojen klorür, birçok endüstriyel süreçte ve laboratuvar uygulamalarında yaygın olarak kullanılır. Hidrojen Klorür Molekülünün YapısıHidrojen klorür, polar bir molekül yapısına sahiptir. Molekül, bir hidrojen atomu ile bir klor atomunun kovalent bağ ile birleşmesiyle oluşur. Klor atomu, hidrojen atomuna göre daha elektronegatif olduğu için, molekül üzerinde bir dipol momenti oluşturur. Bu durum, hidrojen klorürün suda iyi çözünmesini sağlar. Hidrojen Klorürün Fiziksel ve Kimyasal Özellikleri Hidrojen klorür, çeşitli fiziksel ve kimyasal özelliklere sahiptir:
Bu özellikler, hidrojen klorürün endüstriyel ve laboratuvar ortamlarında kullanılabilirliğini etkiler. Hidrojen Klorür Nasıl Çalışır? Hidrojen klorür, çeşitli kimyasal tepkimelerde önemli bir rol oynar. Özellikle asidik özellikleri nedeniyle, pH düzelten maddeler ve çeşitli asit-baz tepkimelerinde sıklıkla kullanılır. İşte hidrojen klorürün çalışma prensipleri:
Endüstriyel Uygulamaları Hidrojen klorür, birçok endüstride çeşitli uygulamalara sahiptir:
Sonuç Hidrojen klorür, hem fiziksel hem kimyasal özellikleri ile dikkat çeken bir bileşiktir. Polar yapısı ve asidik özellikleri, çeşitli endüstriyel ve laboratuvar uygulamalarında geniş bir kullanım alanı bulmasını sağlar. Hidrojen klorür modeli, kimya alanında önemli bir yer tutmakta olup, bilimin ve teknolojinin ilerlemesine katkıda bulunmaktadır. Ek Bilgiler Hidrojen klorür gazı, solunduğunda solunum yolu irritasyonuna ve akciğer hasarına yol açabilir. Bu nedenle, işlenmesi sırasında uygun güvenlik önlemlerinin alınması son derece önemlidir. Ayrıca, hidrojen klorürün depolanması ve taşınması sırasında dikkat edilmesi gereken birçok çevresel faktör bulunmaktadır. |









.webp)