Hidrojen kaç bağ oluşturur?
Hidrojen, kimyasal bağların oluşumunda önemli bir rol oynayan en basit elementtir. Genellikle tek bir kovalent bağ kurabilme kapasitesine sahip olan hidrojen, bazı durumlarda iyonik bağlar da oluşturabilir. Bu yazıda, hidrojenin bağ oluşturma yeteneği ve bu süreçteki etkileşimleri ele alınacaktır.
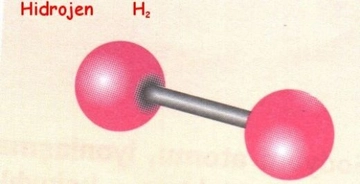
Hidrojen Kaç Bağ Oluşturur?Hidrojen, periyodik tablonun en hafif ve en basit elementi olup, kimyasal formülü H ile gösterilmektedir. Atom yapısı, bir proton ve bir elektrondan oluşur. Bu basit yapısı, hidrojenin birçok kimyasal reaksiyona girmesine ve farklı moleküllerle bağ oluşturmasına olanak tanır. Bu makalede hidrojenin kaç bağ oluşturabileceği, bağ türleri ve hidrojenin diğer elementlerle etkileşimleri detaylı bir şekilde ele alınacaktır. Hidrojenin Bağ Oluşturma Kapasitesi Hidrojen, genellikle tek bir kovalent bağ oluşturabilme kapasitesine sahiptir. Bu, hidrojen atomunun bir başka atomla (genellikle karbon, oksijen veya azot gibi) bir elektron paylaşarak bir molekül oluşturabileceği anlamına gelir. Hidrojenin bağ oluşturma yeteneği, iki ana faktöre bağlıdır:
Kovalent Bağlar Kovalent bağlar, iki atomun elektronlarını paylaşarak oluşturduğu kimyasal bağlardır. Hidrojen, genellikle kovalent bağlar aracılığıyla diğer atomlarla etkileşime girer. Örneğin:
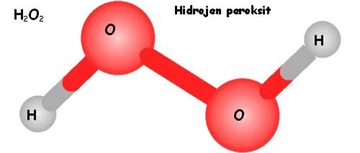
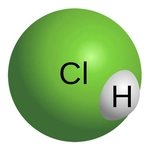
İyonik Bağlar Hidrojen, bazı durumlarda iyonik bağlar da oluşturabilir, ancak bu durum oldukça nadirdir. Örneğin, hidrojen atomu elektronunu kaybettiğinde (H+) bir proton haline gelir ve bu da onu pozitif bir iyon yapar. İyonik bileşiklerde, hidrojen genellikle diğer negatif iyonlarla etkileşime girer. Örneğin, hidrojen klorür (HCl) molekülü, hidrojen iyonu (H+) ve klor iyonu (Cl-) arasında bir iyonik bağ oluşturur. Hidrojenin Moleküler Yapılardaki Rolü Hidrojen, çeşitli organik ve inorganik bileşenlerde önemli bir rol oynar. Özellikle biyolojik sistemlerde, hidrojen atomları birçok biyomolekülün (proteinler, yağlar, karbonhidratlar) yapısında yer alır.
Sonuç Sonuç olarak, hidrojen genellikle tek bir kovalent bağ oluşturarak diğer elementlerle etkileşime girebilir. Bunun yanı sıra, bazı özel durumlarda iyonik bağlar da oluşturabilir. Hidrojenin bu özellikleri, onun kimyasal reaksiyonlardaki önemli rolünü ve çok çeşitli moleküllerin yapısındaki yerini vurgulamaktadır. Hidrojen, hem basit hem de karmaşık bileşenlerin oluşumunda kritik bir unsurdur ve kimya biliminin temel taşlarından birini oluşturur. |









.webp)

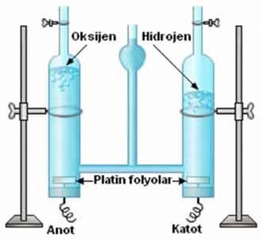





Hidrojenin kaçar bağ oluşturabileceği hakkında çok şey öğrenmiş olduk. Özellikle, tek bir kovalent bağ kurma kapasitesiyle ilgili bilgi veriyor. Peki, hidrojenin bu düşük elektronegatifliği nedeniyle, diğer elementlerle etkileşime girme kolaylığı günlük yaşantımızda nasıl kendini gösteriyor? Örneğin, su molekülünün oluşumunu düşündüğümüzde, hidrojenin rolü bu bağlamda neden bu kadar kritik? Ayrıca, hidrojenin biyolojik sistemlerdeki önemi de dikkat çekici. Enerji taşıyan moleküllerdeki etkisini merak ediyorum; bu nasıl oluyor?
Sayın Sönmez Bey, hidrojenin düşük elektronegatifliği ve tek kovalent bağ kapasitesi, günlük yaşamda ve doğada çeşitli şekillerde kendini gösterir. İşte detaylı bir açıklama:
Su Molekülünün Oluşumu ve Hidrojenin Rolü
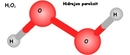
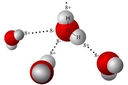
Hidrojen, oksijenle birleşerek su (H₂O) molekülünü oluşturur. Burada her hidrojen atomu, oksijene tek bir kovalent bağla bağlanır. Hidrojenin düşük elektronegatifliği, su molekülünün polar (kutuplu) yapıda olmasına katkıda bulunur; oksijen kısmen negatif, hidrojenler ise kısmen pozitif yüklenir. Bu polarite, suyun yaşam için hayati özellikler kazanmasını sağlar:
- Yüksek yüzey gerilimi ve kohezyon sayesinde bitkilerde suyun yukarı taşınması mümkün olur.
- Mükemmel bir çözücü olarak, besinlerin ve atıkların hücrelerde taşınmasına yardımcı olur.
- Isı kapasitesi yüksek olduğundan, vücut sıcaklığının ve iklimin dengelenmesine katkıda bulunur.
Biyolojik Sistemlerdeki Önemi
Hidrojen, biyomoleküllerin yapısında ve enerji üretiminde kritik bir rol oynar:
- ATP (adenozin trifosfat) gibi enerji taşıyan moleküllerde, fosfat grupları arasındaki bağlarda hidrojen atomları yer alır. Hücre solunumu sırasında, hidrojen iyonları (protonlar) enerji transferinde kullanılır; örneğin, mitokondride elektron taşıma zincirinde proton gradienti oluşur ve bu, ATP sentezini sağlar.
- Karbonhidratlar, yağlar ve proteinler gibi makromoleküllerde hidrojen bağları, yapısal stabilite ve işlevsellik sağlar. Örneğin, DNA'daki hidrojen bağları, baz eşleşmesini düzenleyerek genetik bilginin korunmasına yardımcı olur.
Enerji Taşıyan Moleküllerdeki Etkisi
Hidrojen, enerji metabolizmasında doğrudan ve dolaylı olarak yer alır:
- Glikoz gibi şekerlerin parçalanması sırasında, hidrojen atomları NAD⁺ gibi koenzimlere aktarılır ve NADH oluşur. Bu, enerji depolayan bir molekül olup, oksidatif fosforilasyonla ATP üretiminde kullanılır.
- Yağ asitlerinin beta-oksidasyonunda hidrojen, benzer şekilde enerji açığa çıkarır ve su oluşumuna katkıda bulunur.
Özetle, hidrojenin basit bağ yapısı, onu evrensel bir "yapı taşı" yapar; suyun oluşumundan enerji döngülerine kadar, yaşamın sürdürülebilirliği için vazgeçilmezdir. Bu özellikler, kimyanın temel prensiplerinin günlük hayattaki yansımalarını gösterir.