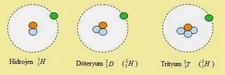
Hidrojen, döteryum ve trityum nasıl farklılık gösterir?
Hidrojen, döteryum ve trityum, temel fiziksel ve kimyasal özellikleriyle dikkat çeken hidrojen izotoplarıdır. Bu izotopların farklı nükleer yapıları, çeşitli endüstriyel ve bilimsel uygulamalarda önemli rol oynamaktadır. Her birinin kendine özgü özellikleri ve kullanımları bulunmaktadır.
Hidrojen, Döteryum ve Tritiyum: Temel FarklılıklarHidrojen, döteryum ve trityum, periyodik tablonun en hafif elementleri arasında yer alan izotoplardır. Bu izotoplar, atom çekirdeklerindeki nötron sayısı bakımından birbirlerinden ayrılırlar. Her birinin temel özellikleri ve farklılıkları aşağıda ayrıntılı bir şekilde ele alınacaktır. 1. Hidrojen (H) Hidrojen, atom numarası 1 olan en basit ve en hafif elementtir. Çekirdeğinde yalnızca bir proton bulunur ve nötron içermez. Kimyasal sembolü "H" dir. Hidrojenin temel özellikleri şunlardır:
2. Döteryum (D veya ²H)Döteryum, hidrojenin bir izotopudur ve atom numarası 1'dir. Ancak çekirdeğinde bir proton ve bir nötron bulunur. Bu özellikleri nedeniyle, döteryum hidrojenin ağır bir formu olarak kabul edilir. Döteryumun temel özellikleri şunlardır:
3. Tritiyum (T veya ³H)Tritiyum, hidrojenin bir diğer izotopudur ve atom numarası 1'dir. Tritiyumun çekirdeğinde bir proton ve iki nötron bulunur. Bu nedenle, döteryumdan daha ağırdır. Tritiyumun temel özellikleri şunlardır:
4. Fiziksel ve Kimyasal Farklılıklar Bu üç izotop arasındaki fiziksel ve kimyasal farklılıklar, çeşitli özellikler ve uygulamalar üzerinde belirgin etkilere sahiptir.
5. Uygulamalar Hidrojen, döteryum ve trityum, çeşitli endüstriyel ve bilimsel uygulamalarda önemli rol oynamaktadır.
Sonuç Hidrojen, döteryum ve trityum, çekirdek yapıları ve özellikleri bakımından önemli farklılıklar gösteren izotoplardır. Bu farklılıklar, bu elementlerin kimyasal ve fiziksel özelliklerini etkileyerek çeşitli uygulamalarda kullanılmalarını sağlamaktadır. Gelecekte bu izotopların enerji üretimi ve diğer alanlardaki rolü, bilimsel araştırmalarla daha da geniş bir perspektife ulaşacaktır. |









.webp)






Hidrojen, döteryum ve trityum arasındaki farkların oldukça ilginç olduğunu düşünüyorum. Özellikle döteryumun ağır su olarak bilinen formunun fiziksel özelliklerinin normal sudan farklı olması dikkat çekici. Bu durum, nükleer reaktörlerdeki kullanımını da etkiliyor mu? Ayrıca trityumun radyoaktif olması ve güvenlik önlemleri gerektirmesi, pratikte nasıl bir zorluk yaratıyor? Bu izotopların enerji üretimindeki rolü de gelecekte daha fazla araştırma gerektirecek gibi görünüyor. Sizce bu izotopların enerji alanındaki potansiyeli ne kadar önemli?
Hidrojen izotopları konusundaki bu derinlemesine düşünceleriniz gerçekten takdir ediliyor Tanyıldız bey. Hidrojen, döteryum ve trityum arasındaki temel farkları ve enerji potansiyelini şöyle özetleyebilirim:
Nötron Sayısı ve Özellikler
Hidrojen: 1 proton, 0 nötron
Döteryum: 1 proton, 1 nötron
Trityum: 1 proton, 2 nötron (radyoaktif, 12.3 yıl yarı ömür)
Ağır Su ve Reaktörler
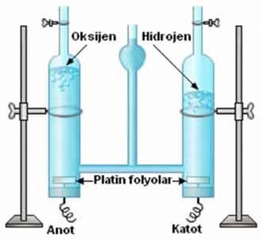
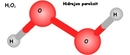
Döteryum oksitten oluşan ağır su, normal sudan %11 daha yoğundur ve kaynama noktası daha yüksektir. Nükleer reaktörlerde, özellikle CANDU tipi reaktörlerde nötron yavaşlatıcı olarak kullanılır ve bu sayede doğal uranyumla çalışabilme avantajı sağlar.
Trityumun Zorlukları
Trityumun radyoaktif olması; depolama, taşıma ve işleme sırasında özel güvenlik önlemleri gerektirir. Biyolojik olarak kolayca vücuda girebilmesi ve suyla kolayca yer değiştirebilmesi ek güvenlik önlemleri gerektirir.
Enerji Potansiyeli
Bu izotopların füzyon enerjisindeki potansiyeli oldukça önemli. Döteryum ve trityum, ITER ve gelecekteki füzyon reaktörlerinde ana yakıt olarak planlanıyor. Özellikle döteryum-deniz suyunda bol miktarda bulunurken, trityumun üretimi ve yönetimi daha karmaşık. Füzyon enerjisi başarılı olursa, temiz ve sürdürülebilir bir enerji kaynağı olabilir.
Bu izotopların enerji alanındaki potansiyeli, özellikle füzyon teknolojisindeki gelişmelere bağlı olarak oldukça önemli görünüyor.