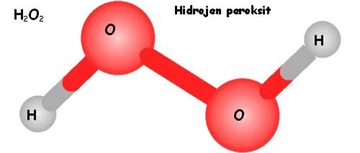
Hidrojen, döteryum ve trityum kimyasal özellikleri benzer mi?
Hidrojen, dötaryum ve trityum, kimyasal özellikleri bakımından benzerlik gösteren hidrojen izotoplarıdır. Bu makalede, her bir izotopun yapısı, reaktivitesi ve uygulama alanları incelenerek aralarındaki farklılıklar ve benzerlikler ele alınmaktadır. Kimya ve fizik alanlarındaki önemleri vurgulanmaktadır.
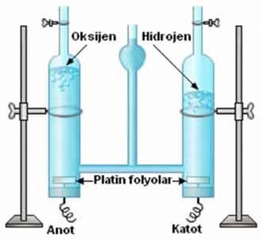
Hidrojen, Döteryum ve Tritiyum: Kimyasal Özelliklerin KarşılaştırılmasıHidrojen, döteryum ve trityum, periyodik tabloda yer alan ve temel özellikleri bakımından birbirine benzerlik gösteren izotoplardır. Bu üç element, atom numarası 1 olan hidrojenin izotoplarıdır ve temel olarak proton sayıları aynıdır. Ancak, nötron sayılarındaki farklılıklar nedeniyle, kimyasal özellikleri üzerinde bazı etkiler yaratmaktadır. Bu makalede, hidrojen, döteryum ve trityumun kimyasal özelliklerini inceleyecek ve aralarındaki benzerlik ve farklılıkları ortaya koyacağız. 1. Hidrojen (H) Hidrojen, en basit ve en hafif elementtir. Atom yapısında bir proton ve bir elektron bulunur. Nötron içermeyen hidrojen atomları, kimyasal tepkimelerde genellikle elektronlarını paylaşarak veya alarak bağlar oluştururlar. Hidrojen gazı (H2), oda sıcaklığında renksiz, kokusuz ve yanıcı bir gazdır.
2. Döteryum (D)Döteryum, hidrojenin bir izotopudur ve bir proton ile bir nötrondan oluşur. Bu ek nötron, döteryumun atom kütlesini artırır ve fiziksel özelliklerini, özellikle de kaynama ve erime noktalarını değiştirir. Döteryum, genellikle ağır su (D2O) formunda bulunur.
3. Tritiyum (T)Tritiyum, hidrojenin bir diğer izotopudur ve bir proton ile iki nötrondan oluşur. Bu nedenle, trityum daha ağırdır ve radyoaktif bir yapıya sahiptir. Tritiyum, özellikle nükleer reaksiyonlarda ve bazı tıbbi uygulamalarda kullanılır.
4. Kimyasal Benzerlikler ve Farklılıklar Hidrojen, döteryum ve trityum arasındaki kimyasal benzerlikler, temel proton sayılarının aynı olmasından kaynaklanmaktadır. Bununla birlikte, nötron sayılarının farklılığı, fiziksel ve bazı kimyasal özelliklerde belirgin farklılıklar yaratmaktadır.
5. Sonuç Sonuç olarak, hidrojen, döteryum ve trityum, kimyasal özellikler bakımından belirli benzerlikler gösterirken, nötron sayılarındaki farklılıklar nedeniyle bazı önemli fiziksel ve kimyasal farklılıklar da sergilemektedir. Bu izotopların özelliklerinin anlaşılması, kimya ve fizik alanlarında önemli uygulamalara yol açmakta ve enerji üretiminden tıbbi uygulamalara kadar geniş bir yelpazede kullanılmaktadır.
Ek Bilgiler |









.webp)






Bu yazıda hidrojen, döteryum ve trityumun kimyasal özellikleri detaylı bir şekilde ele alınmış. Gerçekten de bu izotopların benzerlikleri ve farklılıkları üzerinde durmak, onların uygulamaları açısından oldukça önemli. Özellikle hidrojenin enerji üretimindeki rolü ve döteryum ile trityumun nükleer enerji alanındaki kullanımları çok ilginç. Sizce döteryumun biyolojik sistemlerde yarattığı farklı etkiler, araştırmalara daha fazla yön vermeli mi? Ayrıca, trityumun radyoaktif olmasının getirdiği riskler ve kullanım alanları konusunda dikkat edilmesi gereken noktalar nelerdir?
Keffaret Bey, yorumunuzda hidrojen izotoplarının kimyasal özellikleri ve uygulamalarına dair önemli noktalara değinmişsiniz. Sorularınızı şu şekilde yanıtlayabilirim:
Döteryumun Biyolojik Sistemlerdeki Etkileri:
Döteryumun biyolojik sistemlerdeki etkileri, özellikle "ağır su" olarak bilinen döteryum oksitin (D₂O) canlı organizmalar üzerindeki etkileri araştırmalarda dikkat çekicidir. Yüksek konsantrasyonlarda hücre bölünmesini yavaşlatabilir, enzimatik reaksiyonları etkileyebilir ve metabolizma üzerinde farklılıklar yaratabilir. Bu durum, kanser araştırmalarında hücre davranışlarını anlamak veya biyokimyasal süreçleri incelemek için potansiyel bir araç sunar. Ancak, döteryumun toksik etkileri nedeniyle dikkatli kullanım gerektirir. Biyolojik araştırmalara daha fazla yön verilmesi, özellikle enerji metabolizması ve hücresel işleyiş mekanizmalarının aydınlatılması açısından faydalı olabilir, ancak etik ve güvenlik sınırları göz önünde bulundurulmalıdır.
Trityumun Radyoaktif Riskleri ve Kullanım Alanları:
Trityum, beta ışını yayan radyoaktif bir izotoptur ve bu özelliği nedeniyle dikkatle ele alınmalıdır. Riskler arasında çevreye yayılma potansiyeli, su kaynaklarına karışma olasılığı ve canlı dokularda iyonlaştırıcı radyasyon etkisiyle DNA hasarına yol açabilmesi bulunur. Kullanım alanlarında, nükleer füzyon reaktörlerinde yakıt olarak, radyolüminesans (ışıldama) için saat kadranlarında ve biyolojik izleme çalışmalarında yer alır. Dikkat edilmesi gereken noktalar şunlardır: sıkı radyasyon güvenliği protokolleri uygulanmalı, atık yönetimi titizlikle yapılmalı, maruziyet sınırları uluslararası standartlara uygun şekilde belirlenmeli ve acil durum planları hazır bulundurulmalıdır. Ayrıca, trityumun yarı ömrü (yaklaşık 12.3 yıl) göz önüne alınarak uzun vadeli etkileri izlenmelidir.